私たちの体を構成する組織は、秩序をもった細胞集団によって形成されています。そして個々の細胞は外環境を感知して様々な応答を行うことで生命を維持しています。その細胞応答の1つに周囲の硬さや機械的力の作用を感知して応答するメカノストレス応答と呼ばれるものがあります。これは細胞膜や細胞骨格などの構造にリンクしたタンパク質がセンサーとなり、機械的な力を感知して応答するものです。細胞内アクチン骨格は、細胞の運動と形態を制御する細胞内の動的な構造で、その性質上、メカノストレス応答に重要です。しかし、力という実体のない作用を感知してアクチン骨格を適切に造り変える機構は未だ多くの部分が不明です。細胞は引き伸ばされると抵抗するように収縮力を発生させることが知られています。私たちは、以前、その応答に関与するアクチン骨格の制御因子としてSoloタンパク質を同定しました。Soloは、低分子量Gタンパク質RhoAの活性化因子として働き、RhoAを活性化することでその部位に収縮性のアクチン骨格構造を形成します。本研究は、Soloの機能解析をさらに進めるため、まず、Soloに細胞内で相互作用するタンパク質の探索を行いました。その結果、複数のSolo結合タンパク質を発見しました。その中でSoloと同じようにRhoAを活性化するPDZ-RhoGEF(以降、PRGと表記)というタンパク質に注目して研究を進めました。SoloとPRGをイヌの腎臓由来のMDCK細胞に過剰発現させると、Solo単独では、細胞全体と細胞の基底部にドット状に集積する細胞内分布を示し、PRG単独では、細胞全体と細胞の辺縁部に多く集まる様子が観察されました。これに対し、SoloとPRGを同時に発現させると、PRGの局在が変化してSoloの集積箇所にPRGが集まることが明らかになりました。また、Soloの集積箇所には収縮性のアクチン繊維が形成されますが、PRGがそこに集まるとさらに強くアクチン繊維が集積することが分かりました(図1)。これとは逆に、Soloを過剰発現させた細胞に対してRNA干渉技術を使って細胞が本来持っているPRGの量を減少させると、Soloの集積箇所のアクチン重合が強く阻害されました。また、SoloとPRGのRhoAの活性化に対する働きを解析した結果、Soloは、PRGに直接結合してPRGのRhoAの活性化能を高める働きがあることが明らかになりました。さらに、この関係が細胞のメカノストレス応答にもつ役割を解析するため、細胞が接着する面(細胞外マトリックス)の硬さを操作して解析を行うと、細胞が硬い面に結合した時に形成するアクチン繊維の形成にこのSoloとPRGの結合が必要であることが明らかになりました。本研究によって、Soloタンパク質は、細胞が接着する面の硬さ合わせてPRGを集め、RhoAを活性化し、その部位の硬さに合わせた収縮力を発生させて安定した細胞接着を可能にしていることが推測されました(図2)。

図1. MDCK細胞にYFP-Solo(緑)とmcherry-PRG(マゼンタ)を各々単独(単独の場合は他方の蛍光タンパク質のみの部分を共発現させている。)、又は、共発現させ、各々の細胞内局在とアクチン骨格の形状に対する影響を観察した。矢印は、YFP-Soloタンパク質が細胞内に集積している部位を示している。
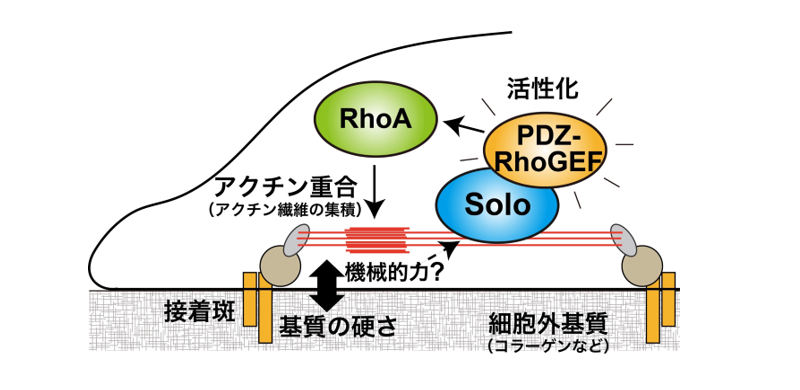
図2. SoloとPDZ-RhoGEFを介し、細胞が基質の硬さに応じてアクチン重合を調節する分子機構のモデル。
(論文情報)
(掲載日:2025年3月3日)
