私たちの体内では、脂質膜に囲われた小胞が常に生成されており、これらが細胞に取り込まれたり、細胞と結合したりすることで細胞の機能を制御することをが知られています。このうちエクソソームと呼ばれる直径50-150 nmの小胞は、タンパク質や遺伝情報を運搬することで、多様な生命現象や疾患と密接に関与することが分かってきました。
本研究では、エクソソームの脂質二重膜に直接結合して蛍光応答を示す機能性分子(蛍光プローブ)を新たに開発し、このプローブが優れたエクソソーム解析機能を発現することを実証しました[1]。私たちはあらゆる種類のエクソソームを検出することを目指して、エクソソームに共通する構造的特徴である、高い曲率を持つ脂質膜を標的とした両親媒性-helixペプチド(Apolipoprotein A-1 のC末端領域 (ApoC))をベースとして[2]、これに長鎖アルキル鎖を導入した近赤外シアニン色素(TRC12)を連結した蛍光プローブを設計・合成しました。ApoC-TRC12は長鎖アルキル鎖部位による疎水性相互作用により高い自己会合能を持っため、ApoC-TRC12は自発的に凝集した構造体を形成することで、ほとんどシアニン色素部位の蛍光は見られません。ここにApoC部位が結合しうる高曲率性脂質膜を持つエクソソームを添加すると、凝集体が解消され、プローブがエクソソームに結合することで、その蛍光強度が著しく増大します。この自己会合・凝集機構による蛍光応答は、ApoC-TRC12とエクソソームを混ぜるという簡便な操作で、数分以内に観測することができます。さらに、ApoC-TRC12は先行研究で開発したプローブや市販のエクソソーム脂質膜応答性プローブと比較して、1桁以上も高感度な検出感度を持っています。このように、本研究ではエクソソーム検出における蛍光プローブの新しい作動原理を実証するとともに、実用的なエクソソーム解析への応用を実現しました。今後は蛍光プローブの機能を更に向上させたり、エクソソームと構造的に類似したmRNAワクチン(脂質ナノ粒子)やウイルス粒子に応用するといった研究を展開していきます。
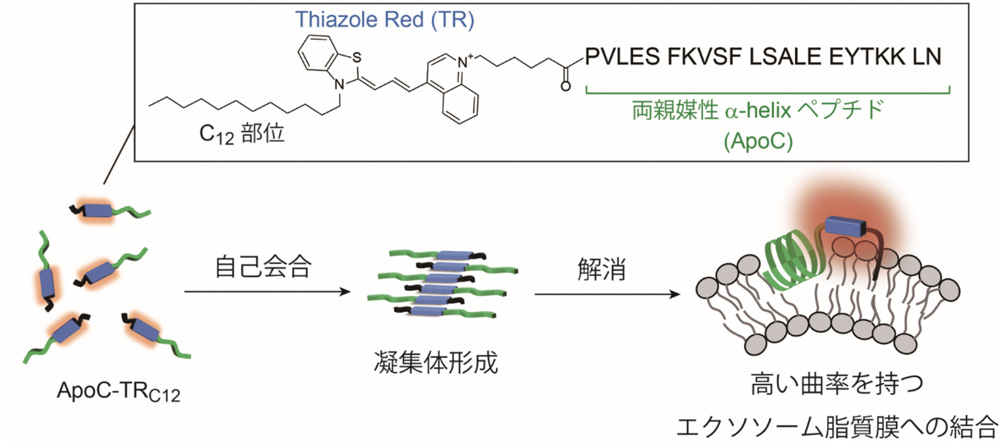
図 自己会合・解消を利用したエクソソーム脂質膜結合性蛍光プローブによるエクソソーム検出法
(論文情報)
(掲載日:2023年2月8日)
