分子は原子同士を化学結合で繋ぐことにより形成されます。化学結合の最も一般的な形は2個の原子が電子を共有することにより生じるもので、共有結合として知られています。通常、共有結合は2個の電子(電子対)を共有しますが、イオンやラジカルでは3個の電子を共有して安定となる場合があることが指摘されており、これを半結合あるいは2中心3電子(2c3e)結合と呼びます。この様な結合がなぜ安定となるのかは、単純なルイス構造式(電子式)では説明できません。その正しい理解には量子力学による電子軌道の概念を必要とするため、これらの結合は非古典的化学結合とも呼ばれています。
水やアンモニアといった非常に基本的なプロトン性分子(H+を付与できる分子)の間に、このような非古典的化学結合がイオン化に伴い生じる可能性が、理論計算により予想されて来ましたが、長い間実験的な証拠が全く得られていませんでした。我々は、硫化水素(H2S)分子のクラスターと呼ばれる集合体を真空中でイオン化し、生じるクラスターイオン(H2S)n+(n = 2 - 6, ここでnはクラスターを構成する分子数)に赤外光を照射し、赤外光吸収の波長依存性から分子内の振動状態を探りました(これは赤外分光と呼ばれる研究手法です)。その結果、クラスターイオンの中心となる2つの硫化水素分子の間に半結合が形成され、さらにこの結合は溶媒和(周囲を分子で取り囲まれること)されても他の結合形式に変化すること無く安定に存在することを証明することに成功しました。イギリス王立化学協会発行の化学ニュース雑誌Chemistry Worldは、この結果を「分子分光学の勝利」という評価と共に紹介しています。分子分光学とは、この研究のように、目には見えない分子の状態を分子による光の吸収、発光、散乱を通して明らかにする研究分野を指します。
関連リンク
https://www.chemistryworld.com/news/first-observation-of-unusual-hemi-bond/2500314.article
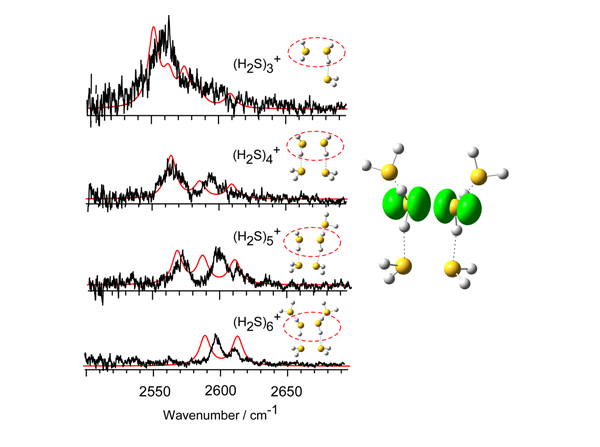
左図)測定された(H2S)n+クラスターイオンの赤外スペクトル(黒線)。SH結合の伸縮振動による吸収が現れている。赤線は図中のクラスター構造に基づく理論スペクトル。理論スペクトルは図中の構造に基づいて計算されている。各クラスター構造では、電荷を持ち、半結合により結ばれた部分が赤丸で強調されている。分子を結ぶ黒点線は水素結合を表している。
右図)半結合(2中心3電子結合)で結ばれた硫化水素分子の電子スピン分布。電子スピンとは量子力学により現れる電子の性質であり、その分布は不対電子の分布と見なすことが出来る。図中の分布は、電子対に加えて3電子目となる不対電子が中心の2分子間で共有されていることを示している。
(論文情報)著者・雑誌名・掲載ページ・DOI・論文URL
Dandan Wang, Asuka Fujii, Chem. Sci. 2017, 8, 2667-2670. DOI: 10.1039/c6sc05361k
http://pubs.rsc.org/en/Content/ArticleLanding/2017/SC/c6sc05361k#!divAbstract
(掲載日:2017年11月7日)
